简介
细胞表型(包括形态和分子特征)的动态变化监测对于揭示环境刺激或基因干扰下的细胞响应的机制至关重要。虽然许多分子标记物(如细胞表面标记物,报告蛋白或小分子)可以用于单细胞表型,但这些分析通常是在单一预定终点进行的。
常见的基于流式细胞术的方法需要终止实验而获取细胞群,由于使用长时间和劳动密集型的步骤,因而妨碍了对细胞表型变化的实时和动态分析。然而,细胞状态的变化是动态的,并且在许多情况下,细胞表型发生改变的开始时间和分子变化的事件是未知的。因此,终点分析并不能准确描述表型变化及其程度,可能产生令人困惑的结果。
相比之下,在单细胞水平上的动态测量可以确定表型改变的动力学,以及短暂和长期改变之间的分化,还有助于识别环境刺激、适应性反应和间接效应之间的潜在因果联系。通常,这些测量主要是在报告细胞系/菌株中进行的,需要对感兴趣的生物进行基因修饰。不幸的是,目前可以在任何感兴趣的时间点执行、允许动态和连续监测、并适用于广泛生物系统的混合读取的分析方案非常少。
对单个细胞的可靠识别(细胞图像分割)是在单细胞水平上量化表型标记物的一项重要任务。细胞核在所有活细胞中普遍存在,其一致的球形形状以及多个DNA结合荧光团的可用性使细胞核成为荧光显微镜图像中染色和随后分割细胞的理想特征。
由于细胞核在细胞内的中心位置,即使是紧密相邻的细胞也很容易区分,这为定义具有胞质或胞膜定位的标记物的二次检测区域提供了基础。蓝色荧光染料(如DAPI,Hoechst染料)是常用的核探针,用于与其他标记目标表型的荧光探针进行多重检测,包括绿色荧光FITC偶联物,红色荧光TRITC偶联物和死细胞染色剂(如碘化丙啶)。
DNA结合荧光分子的反复暴露和激发可导致光毒性DNA损伤,阻碍活细胞在较长时间内的连续成像。通常认为光毒性是长时间荧光成像广泛应用的一项关键限制,但高灵敏度荧光显微镜的持续改进为降低核探针的剂量和毒性提供了新的可能性。
本应用指南系统地描述了应用Spark Cyto进行活细胞的核染色并在重复曝光和连续荧光成像期间保持最小的细胞毒性的实验参数,以及使用Spark Control™和Image Analyzer™软件进行可靠的自动细胞图像分割。优化的程序用于多重三色实验,以识别和区分凋亡性细胞死亡的早期和晚期阶段,为动态长期表型的追踪奠定了基础。
材料与方法
细胞培养。人类癌症细胞株A549、MDA-MB-468和UO-31来自美国国家癌症研究所(NCI, Bethesda, MD,U S )。细胞保持在R P M I - 1 6 4 0 细胞培养液中(##21870076,Thermo Fisher Scienti‑c),并添加5%透析胎牛血清(#F0392,Sigma Aldrich), 2 mM 谷氨酰胺(#25030024,Thermo Fisher Scienti‑c)和1% 青霉素/链霉素溶液(#15140122,Thermo Fisher Scienti‑c)。
染料和荧光探针。核染色采用Hoechst 33342(10mg/ml, #H3570,Thermo Fisher Scienti‑c)。如下所述稀释贮存液,并补充到生长细胞培养的培养基中。在黑暗环境(37°C,5% CO2)中初始孵育30分钟后开始成像。Apo Tracker Green (200 nM,Bio Legend)是一种与暴露在细胞表面的磷脂酰丝氨酸(PS)残基结合的探针,用于检测早期凋亡细胞。与能和PS结合的annexin V相反,Apo Tracker Green的结合不依赖钙,可用于低钙的细胞培养基,如RPMI -1640。用终浓度为0.5 μg/ml的活细胞不渗透的染料碘化丙啶(PI,Sigma Aldrich,#P4864)鉴定细胞膜受损的溶解/坏死和晚期凋亡细胞。
细胞凋亡的药理诱导。用5 - 氟尿嘧啶( 5 - F U ,#F6627,Sigma Aldrich)处理贴壁细胞,诱导其生长抑制和凋亡。将粉末溶解在0.1 M NaOH中,无菌过滤后,稀释在细胞培养基中,获得50 mM的储备液。
明场和荧光成像。细胞在低汇合度(20-30%)接种到处理后的96孔细胞培养板(Nunclon™Delta表面处理细胞培养板,#167008,Thermo Scienti‑c),并在37°C和5%的CO2中培养过夜使细胞附着。在实验开始时,将三种荧光探针平行添加到每孔中进行药物处理。在初始孵育30-45分钟使核染色平衡后,将孔板插入Spark Cyto进行连续孵育(37°C,5% CO2)并进行自动荧光成像。使用Spark Control创建一个固定3小时间隔的动态循环程序,包括使用多色应用程序的进行荧光成像,和使用2X物镜和汇合度应用程序的分析细胞汇合度。在这两种模式下,使用自动边界检测对整个微孔进行成像。
选择4X物镜和多色应用程序进行荧光成像的实时图像分析。选择蓝、绿和红荧光和明场通道,曝光时间分别为,蓝色荧光(Hoechst 33342)60 ms,绿色荧光(Apo Tracker Green)150 ms,红色荧光(PI)200 ms。多色分析的设置根据核染色(Hoechst 33342,一级掩膜)和两项额外的次级掩膜,半径为 14 m并激活 Voronoi掩模选项。为优化绿色和红色信号的检测参数,设置绿色和红色荧光强度阈值分别为0.02和0.01RFU。核计数和每组细胞占比(即蓝+/绿+、蓝+/红+或蓝+/绿+/红+)在Spark Control中对每个时间点实时分析,并能以Microsoft Excel®格式导出便于后续分析和可视化处理。
数据分析。图1-3中的数据图是在Matlab 2018b中生成的。图3c-f所示的动力学参数是直接从动态测量和图像分析中导出的。对于每个浓度的5-FU,在整个实验期间(72小时)的所有时间点上观察到蓝色和绿色信号的细胞的最大百分比来确定早期凋亡细胞的最大占比(图3c)。为了表示晚期凋亡和细胞死亡(图3d),我们测定了不同剂量5-FU 在72小时出现蓝色和红色信号的细胞比例。凋亡的开始(图3e)定义为观察到蓝色和绿色信号的细胞比例最大的时间(图3c)。为了估计细胞凋亡率(图3f),定义为蓝色和绿色信号细胞分数每小时增加的最大值,将蓝色和绿色细胞比例的动态数据分成20个重叠部分,每个部分包含5个数据点(15小时),利用Matlab函数进行线性拟合计算斜率(细胞% / 小时)。图3f显示观察到的20个时间点的最大斜率(凋亡细胞%/小时)。
结果与讨论
优化长期活细胞成像的核染色
细胞核是所有活细胞的基本组成部分,明确的功能特征使其成为荧光成像中自动检测细胞和单个细胞核的理想工具(图1a)。除了细胞计数,荧光图像还可以在单细胞水平上进行多水平表型表征,通过定义二级掩膜,为每个单个细胞分配二级测量细胞表型的报告分子。为了研究这种多色成像试验中的核染色,我们探索了细胞渗透性蓝色荧光染料Hoechst 33342对长期成像的适应性,以及多路复用绿色和红色荧光探针的可能性。
尽管与细胞核DNA选择性紧密结合的特征使Hoechst33342成为一种强有力的核染料,但也可能会导致染料分子在细胞核中大量聚集。其在紫外线(UV)光谱范围内被激发,这加剧了光毒性DNA损伤的风险。因此,本研究旨在寻找在低光毒性条件下有效的核染色实验条件,通过最小化Hoechst 33342的浓度来减少核染色的风险。
为了确定Hoechst 33342的最佳浓度,在不同浓度对贴壁生长人类癌症细胞染色,细胞的汇合度(代表细胞活率)和蓝色目标计数连续监测96小时,动态周期设置固定时间间隔为2小时。终点分析法常用的检测的浓度范围从31ng/ml到1μg/ml,使用确定对细胞活率和细胞图像分割的影响。我们选择了三种人类癌症细胞株,A549肺癌、MDA-MB-468乳腺癌和UO-31肾癌,来评估潜在的细胞类型特异的灵敏度和成像特性。
细胞汇合度数据显示,在存在Hoechst 33342时所有三种类型细胞的生长均受到强烈的浓度依赖性抑制。这出现在最初的24小时(图1b),与之前报道的长期活细胞成像中的光毒性一致。虽然Hoechst 33342浓度的降低能解决对所有三个细胞系在细胞生长上的负面影响,但一个关键问题是,如此低的浓度是否仍然可以进行细胞核图像分割。
为了取得细胞核分割和毒性之间的最佳平衡,在长期孵育期间,系统地比较了不同浓度Hoechst 33342下动态增加的细胞数量(图1c),这由细胞汇合度和蓝色目标计数决定。在最佳染色条件下,预期细胞汇合度和蓝色目标计数的相对增加是一致的,并且与未染色培养组中细胞汇合度的动态增加相匹配。然而在所有的细胞系里使用非常低和非常高浓度的未染色对照中观察到大的偏离, 同时发现在MDA-MB-468细胞和UO-31细胞中62.5和125ng/ml浓度的Hoechst 33342导致蓝色目标计数(图1c中第2和3行)与细胞汇合度数据一致。这表明能实现符合要求的细胞核分割。
对A549细胞,浓度稍高是最合适的,250ng/ml的浓度对生长没有负面影响,核计数直到培养达到完全汇合(大约48小时)都是可靠的(图1c中第1行)。A549中低剂量的Hoechst 33342缩短了蓝色目标计数充分反映细胞汇合度数据的时间窗口。这表明可能会由于荧光强度低,对细胞核的识别不完全。
形态上的差异(图1d)可能是由于不同细胞类型特异性最佳浓度略有不同。球形MDA-MB468细胞的细胞核区较密集,需要较低的浓度就能达到可靠分割的信号阈值。相比之下,A549细胞形状扁平,意味着核体积分布在更大的区域,这降低了像素强度,可能导致核分割的灵敏度相对较低。
总的来说,结果表明在不影响分割质量的情况下,Hoechst 33342浓度降低8倍是可能的。与传统染色方案相比,有机会解决光毒性问题。
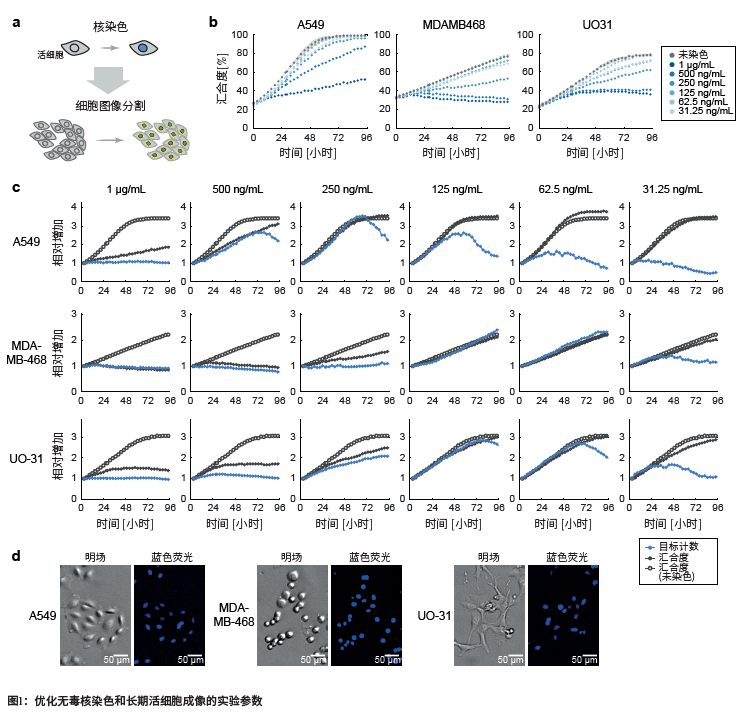
(a) 细胞核的荧光标记允许使用细胞图像分割分法在荧光图像中定位单个细胞。
(b) 在增加DNA结合核染料Hoechst 33342浓度的情况下,三种不同癌细胞系的细胞汇合度的动态监测。图像由Spark Cyto在4倍放大倍数下获取,并使用汇合度应用程序实时分析细胞的汇合度(细胞所覆盖的微孔面积百分比)。(c) 根据细胞汇合度(黑色线条)和蓝色目标计数数据(核计数,蓝色线条)以及在未染色细胞培养中测量的细胞汇合度(空心黑色线条)重建的生长动态。
(d) A549、MDA-MB-468和UO-31细胞用125 ng/mL的Hoechst 33342染色后的明场和蓝色荧光图像,显示了不同的形态和细胞核区域。所有图像都是在Spark Cyto中以4倍放大倍数获取。为了便于观察,增强了蓝色荧光图像中的对比度。
三色分析法在原位贴壁细胞培养中检测早期凋亡
Spark Cyto采用三色荧光成像方法原位检测凋亡细胞,结合使用优化后的核染色步骤和二级标记物。细胞凋亡是程序性细胞死亡的一种形式,是一种与健康和疾病密切相关的标志性细胞表型。凋亡性细胞死亡是发育的组成部分,包括组织稳态的调节,也具有阻止疾病进展的有利药理作用。
存在不同的荧光探针来检测已经在早期阶段(1,2)诱导的细胞凋亡,包括结合外源磷脂酰丝氨酸(PS)残基的荧光团偶联蛋白,例如膜联蛋白annexins。由于探针接近靶标不需要膜渗透,因此该方法只需通过简单地将探针添加到细胞培养基中来原位标记活细胞。
最常用的膜联蛋白(annexin V)需要钙离子的存在才能有效结合PS, 本研究选择了Apo Tracker™Green(Biolegend)。这种最近开发的探针可以不依赖Ca2+结合(3),并能在低钙的环境和培养基(例如RPMI-1640)中检测PS易位。为了区分凋亡和坏死细胞的死亡机制(图2a),碘化丙啶作为细胞不渗透的荧光探针,仅在膜完整性受损时与细胞DNA结合,表明细胞溶解和死亡。膜完整性的丧失也发生在凋亡的后期,导致Apo Tracker Green和碘化丙啶同时标记的细胞出现。
该方法无需额外的样品操作就能检测细胞药理学凋亡。A549肺癌细胞用500 μM 5-FU处理,然后加入Hoechst33342、Apo Tracker Green和碘化丙啶,在Spark Cyto的受控环境(37°C, 5% CO2)中孵育,42小时后得到明场和荧光图像(图2b-c)。使用Spark Control中的多色应用程序,根据二级标记自动对Hoechst 33342阳性细胞进行多色分类:
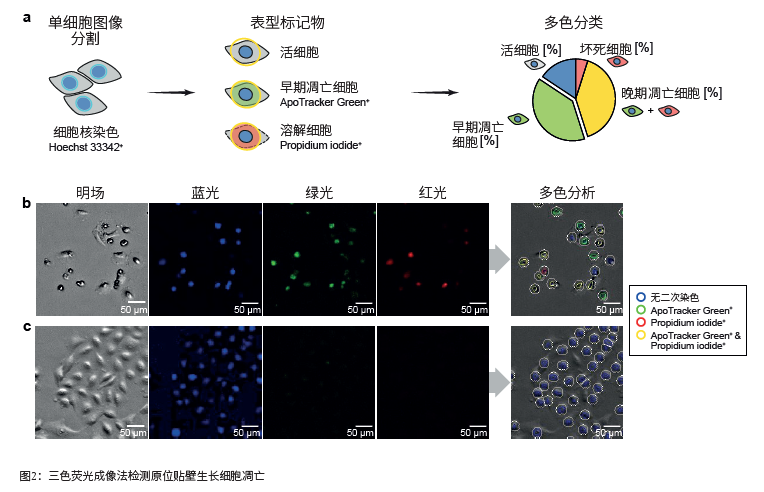
(a)实验原理概述。用低浓度Hoechst 33342染色活细胞的细胞核,在蓝色荧光图像中分割细胞核。在细胞核周围一定半径处定义二级分割掩模(黄色圆圈)用于测定二级标记物。使用Spark Control中的多色应用程序,自动将染色细胞分类为活细胞(仅标记核)、早期凋亡细胞(Apo Tracker Green+)、晚期凋亡细胞(Apo Tracker Green+/碘化丙啶+)或溶解细胞(碘化丙啶+)。用5-FU处理A549肺癌细胞(b)的凋亡与未处理的对照组(c)比较。在Spark Cyto中用4倍放大获取明场、蓝色、绿色和红色荧光图像。
• 活细胞(无二次染色);
• 早期凋亡细胞(Apo Tracker Green+);
• 晚期凋亡细胞 (Apo Tracker Green+ 和碘化丙啶+);
• 溶解细胞/坏死细胞(碘化丙啶+)。
在5-FU处理的细胞(13,179±636蓝色目标)和对照组(5,927±191蓝色目标)之间观察到细胞核数量的巨大差异,这与细胞汇合度(分别为46±2%和71±5%)的巨大差异一致。在5 - F U 处理的细胞培养中, 早期凋亡细胞(Apo Tracker Green+)的比例也显著升高,占所有检测到的细胞核的20±1%,而在未处理的对照组中为0.7±0.6%。
此外,在加入5-FU 的42小时后,可以看到一小部分处于凋亡晚期阶段的细胞(Apo Tracker Green+/ 碘化丙啶+),占细胞总数的28±1%,而在未处理对照组中则不到1%。在5-FU处理的培养物中,仅碘化丙啶染色的溶解细胞很少见,而在未处理的培养物中则不存在(分别为3±0%和0±0%)。总之,结果表明三色分析法能准确检测和区分活细胞培养中的早期和晚期凋亡。
全自动实时监测细胞凋亡诱导
优化后的三色分析法用于动态监测5-FU剂量依赖性诱导的细胞凋亡。A549肺癌细胞在96孔板3复孔用增加剂量的5-FU处理后,在Spark Cyto中72小时监测活细胞、早期和晚期凋亡细胞以及坏死细胞的比例和细胞汇合度。为了动态进行荧光成像和多色分析,Spark Control里设计固定3小时间隔的动态循环程序,以获取明场、蓝色、绿色和红色荧光图像并进行实时图像分析。
PS残基从细胞膜的内表面易位到外表面是细胞诱导凋亡后的早期事件,发生在细胞膜完整性丧失之前,因此Apo Tracker Green染色被认为先于碘化丙啶染色。随着凋亡性细胞死亡的发展,细胞经历膜完整性的丧失,导致出现一批晚期凋亡细胞,这些细胞同时表现Apo Tracker Green和碘化丙啶染色。细胞汇合度分析显示,浓度低至5μM的5-FU处理时可导致强烈的生长抑制,而在浓度高于250μM时,随着时间的推移,可以观察到细胞汇合度明显减少(图3a),可能表示细胞萎缩和脱离。荧光成像和多色分析证实随着5-FU浓度的增加,其毒性逐渐加重。当浓度低于100μM时,生长抑制占主导,细胞死亡很少,早期凋亡迅速增加,ApoTracker Green+细胞在高剂量5-FU时大约24小时开始出现(图3b)。在早期凋亡细胞出现这个早期高峰后,ApoTracker Green+/ 碘化丙啶+晚期凋亡细胞急剧增加(图3b),这与细胞凋亡的快速发展相一致。
总的来说,动力学数据证明了凋亡诱导过程中预期的事件过程,同时揭示了5-FU促凋亡作用的强剂量效应关系。加上早期凋亡细胞的最大百分比和晚期凋亡/死亡细胞的最大百分比(分别为图3c和3d),诱导凋亡的时间和速率也强烈依赖于5-FU的浓度(图3e-f)。在预定义的终点测量往往只能提供一个瞬时快照,而动力学数据允许查看细胞凋亡诱导过程的任何动力学参数。

(a-b) A549细胞使用不同剂量的5-FU处理,并加入Hoechst 33342、ApoTracker Green和碘化丙啶。在Spark Cyto中使用动态循环程序(间隔3小时)和汇合度程序和多色应用程序进行72小时的细胞汇合度(图a)和凋亡诱导(图b)的动态监测。
(c-f) 诱导凋亡的动力学参数呈浓度依赖性关系,包括早期凋亡细胞的最大百分比(图c),72小时后晚期凋亡细胞和死亡细胞的百分比(图d),早期凋亡的发生,即早期凋亡细胞分数达到最大值的时间(图e),以及早期凋亡率,即描述早期凋亡细胞增加的最高斜率(早期凋亡细胞每小时百分比,图f)。所有参数均来自图b中的动态数据。
结论
动态跟踪细胞表型和生理学改变的方法为基础研究和药物发现应用中的细胞群的详细功能表征铺平了道路。虽然破坏性和劳动密集型实验方式,主要基于流式细胞术测量,迄今为止限制了表型测量的可扩展性和通量,但活细胞成像技术的最新发展重新点燃了开发动态和长期成像和表型跟踪实验程序的动力。本应用指南描述了通过使用低浓度的常见核染料Hoechst 33342来解决光毒性问题的优化细胞核染色系统性方案。Spark Cyto中强大的全孔荧光成像技术,结合Spark Control和Image Analyzer中灵敏的分割算法,允许将这种染色方案用于长期活细胞成像,以及与其他荧光探针进行多重检测,以评估复杂的细胞表型,如细胞凋亡。
Spark Control可实施定时自动明场和荧光成像,无需用户干预,多色应用程序可实时定量显示不同表型的细胞百分比,具有出色的重复性。总体而言,Spark Cyto为细胞表型的动态跟踪提供了一个理想的平台,并在预定的终点提供细胞表型的动态数据编码机制的相关信息,而不仅仅是静态快照。
参考文献
[1] Banfalvi G.Methods to detect apoptotic cell death. Apoptosis,2017,22(2),306-323.
[2] Smith BA,Smith BD.Biomarkers and molecular probes for|cell death imaging and targeted therapeutics.Bioconjug Chem,2012,23(10),1989- 2006.
[3] Barth ND,et al.A fluorogenic cyclic peptide for imaging and quantification of drug-induced apoptosis.Nat Commun.2020, 11(1),4027.
(文章来源:hmez.huimeihealth.com.cn/hm/scrm/scrmmobile/eda/1654414933828620288) |