简介
钙离子(Ca2+)是细胞内信号转导中重要的第二信使,参与基因表达、增殖、分化和细胞死亡等关键细胞过程。Ca2+浓度在细胞外(1.5 mM)和细胞内(胞浆内100 nM)以及细胞内结构之间存在显著差异。细胞外Ca2+进入细胞内或者内质网释放存储在细胞内的Ca2+,会使胞浆内Ca2+浓度增加,从而启动细胞内Ca2+信号通路。质膜上还有几个离子通道控制Ca2+从细胞外进入细胞内,例如电压门控钙通道(VGCCs)。
细胞内异常的Ca2+信号传导和Ca2+紊乱与多种疾病有关,包括神经退行性疾病和各种癌症。此外,钙离子通道的高水平表达与治疗性抗拒、干细胞状态、自我更新和癌细胞的迁移能力有关。几种常见的化疗药物会干扰癌细胞中的Ca2+稳定性和Ca2+信号传导。因此,对细胞内Ca2+的监测是一种有用且应用广泛的实验方法。
Fluo-4是一种经典荧光染料用于监测细胞内Ca2+,其与Ca2+结合后绿色荧光增强。将溶解好的Fluo-4直接添加到含有培养细胞的微孔板中,细胞可以载入乙酰氧基甲酯(AM)形式的Fluo-4,然后可以通过标准荧光检测或基于荧光的细胞成像检测Fluo-4。
在Spark Cyto上可以同时实现这两种功能。该系统是第一台活细胞实时成像酶标仪,可实现细胞培养的半自动化实验流程。它将多功能检测模块和荧光成像相结合,可以在单个实验中对细胞样本进行可视化和功能检测。
Spark Cyto配备了高端成像模块,包括三个可选的物镜、四个荧光通道、一个LED照明和高度可靠、快速自动的聚焦系统。通过用户友好和直观的SparkControl™软件,Spark Cyto可以实现动力学分析的自动化,如全环境控制、动力学软件和动态调节能力,为复杂的实验设计提供了一套简单的解决方案。
本文描述了一种使用Spark Cyto多色荧光成像和ImageAnalyzer™软件分析胞内Ca2+浓度和Ca2+摄取的半高通量方法。通过钙离子载体-离子霉素处理增加细胞内Ca2+浓度,用Fluo-4结合使用细胞核染料Hoechst 33342进行定量检测。
材料和方法
细胞培养
KKU-055细胞(人胆管癌细胞系;JCRB)在标准细胞培养条件下(37°C,5%CO2),在DMEM培养基(Gibco)中,生长至约80%汇合度。DMEM培养基中添加10%胎牛血清(FBS,Biochrom),1%抗生素-抗真菌溶液(ABAM,Merck),1mM丙酮酸钠(Merck),以及10mM HEPES(Merck)。
试剂
将Hoechst 33342溶液(20 mM,ThermoFisherScienti‑c)、Fluo-4、AM(ThermoFisher Scienti‑c,溶解于DMSO中至1 mM的浓度) 和离子霉素(Merck,溶解于DMSO中至1 mM的浓度)分装,并在-20°C下储存。
染色和离子霉素处理
用胰蛋白酶/EDTA(Merck)处理收集细胞,并以每孔7500个细胞的密度接种在96孔板(Tecan)中,过夜培养。用无血清的DMEM(sfDMEM)清洗细胞一次,加入Hoechst 33342(1μM)和Fluo-4(0.5μM),在细胞培养箱中培养10分钟。在培养孔中添加离子霉素(1μM)后立即开始检测。
仪器
Spark Cyto 600
检测方案和分析
荧光成像(蓝色通道检测Hoechst细胞核染料,绿色通道检测Fluo-4阳性细胞)通过动力学循环(5个周期,每个周期2分钟)检测胞内Ca2+的时间依赖性变化。为了分析单细胞水平的胞内Ca2+,并验证实验方案的动态适用性,动力学循环设置一个条件(每孔计数5000个带绿色荧光的细胞)。使用Image分析软件的Voronoi分析功能分析双阳性细胞,并确保单细胞水平的可靠测量。为了评估Voronoi分析的特异性,同时使用了多色荧光成像仪的分析功能,两者选用相同的分析选项设置。有关详细设置,请参见图1。
数据统计
所有数据点代表7次重复的平均值,±标准平均误差(SEM)。使用OriginPro®2019b(OriginLab)进行计算。
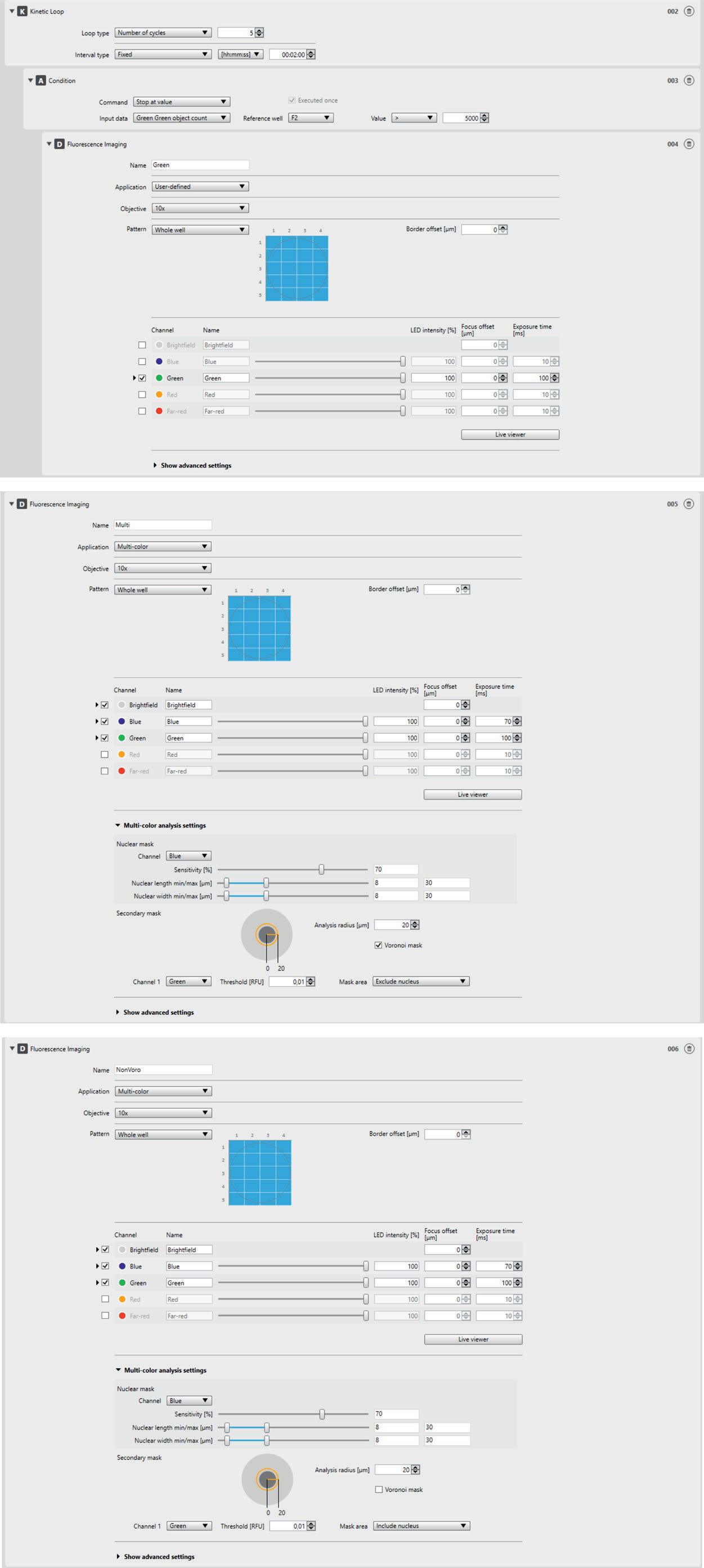
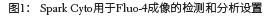
结果和讨论
使用动力学循环功能,可以可靠地监测离子霉素处理后细胞内Ca2+的增加,并为随后在单细胞水平上分析细胞内Ca2+定义了一个条件(5000个绿色荧光的细胞)。实验数据如图2所示。
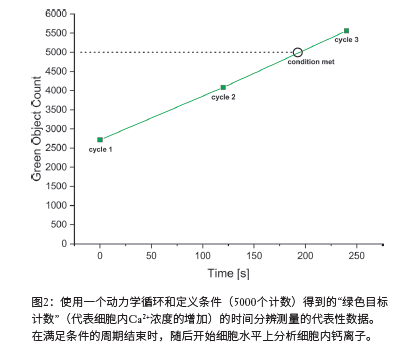
为了在细胞水平上检测钙流的大小,把多色荧光成像与Voronoi分析相结合。同时检测蓝色和绿色的双阳性细胞,代表胞内钙流增加。此外,为了检测Voronoi分析的特异性,对常规(非Voronoi)分析进行了相同的实验。
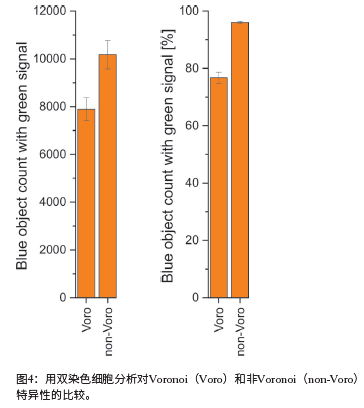
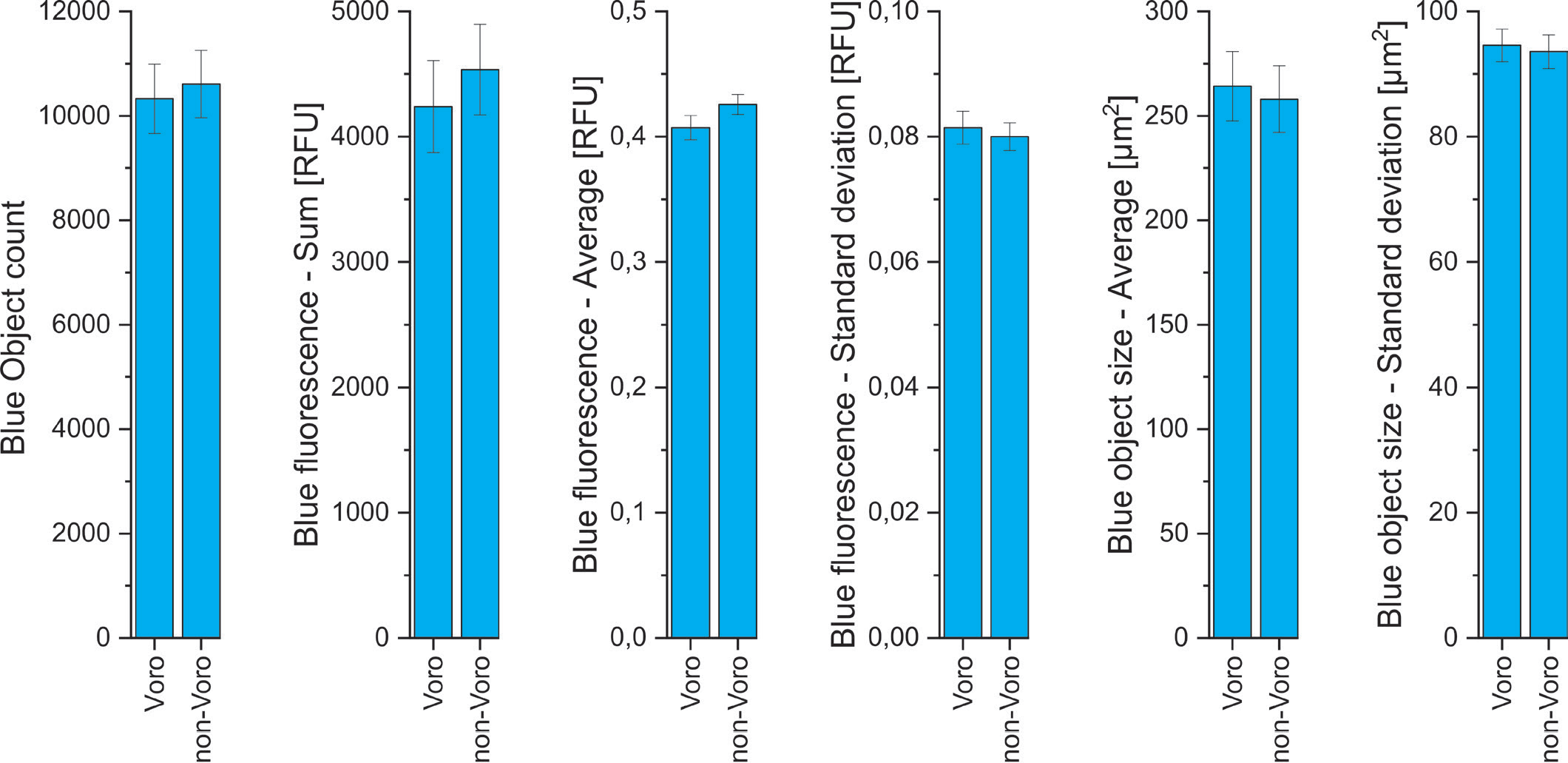
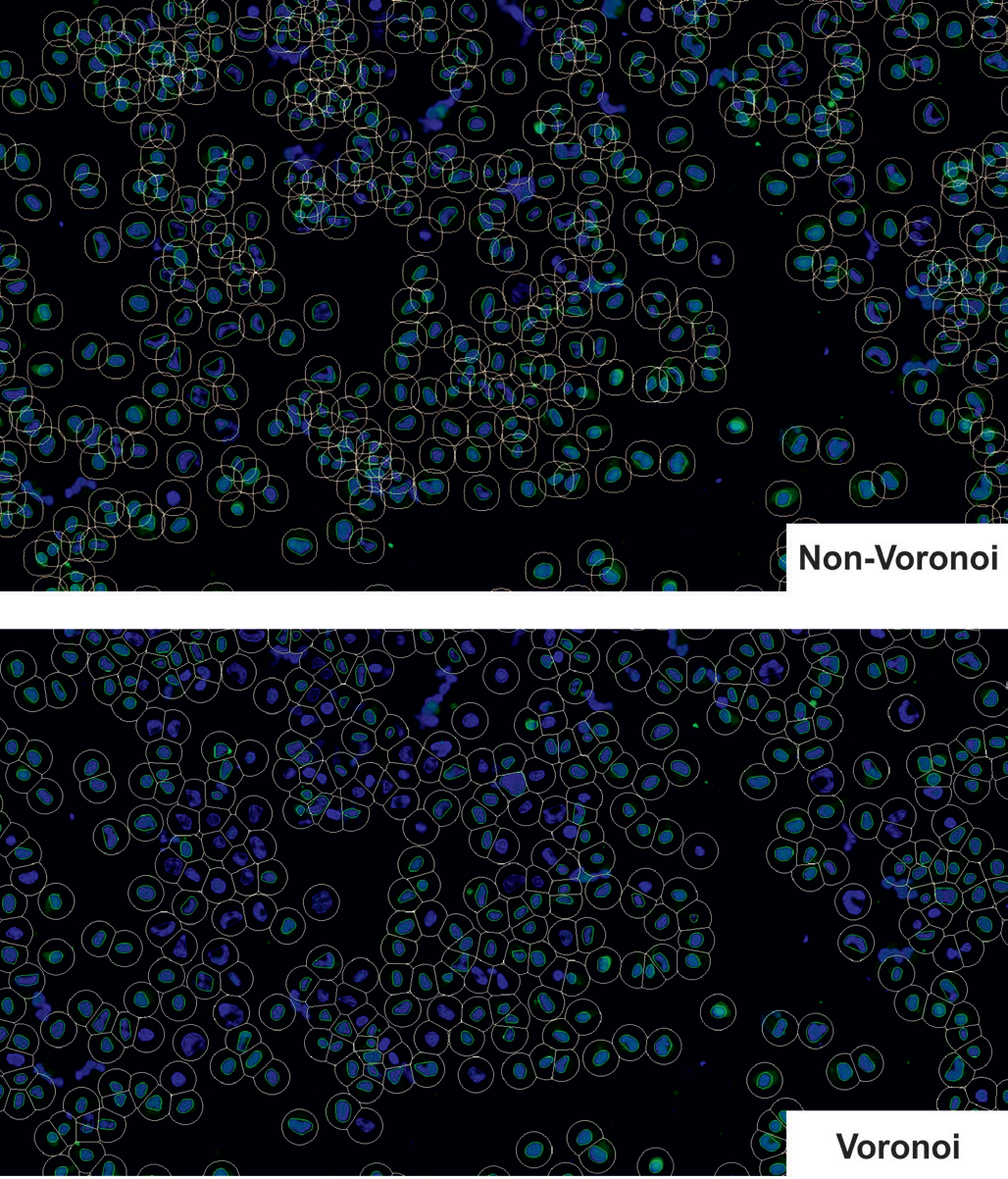
正如预期的那样,分析模式(Voronoi与非Voronoi)对与核染色相关的结果没有影响(图3)。然而,与非voronoi相比,Voronoi分析导致了“带绿色信号的蓝色目标计数”(即双染色细胞,见图4)的值相对更低。如图5所示,这种现象是由于Voronoi分析的特定算法,从而减少了假阳性。非Voronoi分析会产生重叠计数事件,因此会产生假阳性信号(图5,上),而使用Voronoi分析可以更精确地解决这些重叠计数事件(图5,下)。

结论
将多色荧光成像与Voronoi分析相结合是实时测量细胞水平钙离子变化的可靠工具。此外,结合Ca2+敏感染料和核染色可以在细胞水平上分析细胞内Ca2+。在这个设置中,Voronoi分析优于非Voronoi分析,因为它最小化了假阳性结果。这里提供的方案是可扩展的,适用于半高通量的应用。
(文章来源:hmez.huimeihealth.com.cn/hm/scrm/scrmmobile/eda/1654332953925570560) |